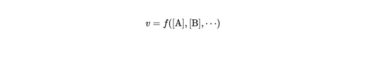化学熱力学で反応速度を考えるに当たって知っておかなければいけない言葉の一つに反応次数があります。
今回はこの反応次数について説明していきます。
結論:反応次数とはなにか
結論から先にお伝えします。
反応次数とは、以下の式におけるa,b,…のことです。
$$
v=k_{\mathrm{r}}[\mathrm{A}]^{a}[\mathrm{B}]^{b} \cdots
$$
つまり速度式において、それぞれの反応物の濃度が反応速度にどれほど寄与しているかの指標となります。
今回は物理化学のなかでもとくに反応論の反応速度について説明します。 そのなかで、速度式と速度定数というものがでてきます。 それが何なのかをなるべくわかりやすく解説していきます。 速度式とはなにか 速度式(rate equat[…]
全次数
また、全次数という用語もセットで覚えておきましょう。
全次数とは、先ほどの反応次数の和のことです。
全次数は、速度式の濃度の次数 a,b,c,d…を使って、a+b+c+d…と表せます。
反応次数の例
それでは具体的に反応次数の例をみていきましょう。
例① Aの反応次数:1 Bの反応次数:1
$$
v=k_{\mathrm{r}}[\mathrm{A}][\mathrm{B}]
$$
この場合、全次数は2となります。
例② Aの反応次数:2 Bの反応次数:1
$$
v=k_{\mathrm{r}}[\mathrm{A}]^{2}[\mathrm{B}]
$$
この場合、全次数は3となります。
例③ Aの反応次数:1 Bの反応次数:1/2
$$
v=k_{\mathrm{r}}[\mathrm{A}][\mathrm{B}]^{1/2}
$$
この場合の全次数は1.5です。
このように反応次数は必ずしも整数とは限らないことに注意してください。
反応次数の特殊な例:反応次数:0
反応次数が0である反応
反応によっては反応次数が0というものもあります。
仮に全ての反応物の反応次数が0になるときを考えます。
つまり全次数が0になるときの速度式は次のようになります。
$$
v=k_{\mathrm{r}}
$$
このように反応速度が表されているとき、速度が濃度によらないということがわかります。
では、反応速度が濃度によらないということはどういうことでしょうか?
速度が濃度に無関係ということは次のようなことを意味します。
・反応速度は一定
当然、反応速度が濃度によらないので、どれだけ反応が進行しても速度は変化しません。
そしてさらにこのことをもっと細かく考えると次のようにも言い換えられます。
・濃度を大きくしても速度は速くならない。
・反応が進んで濃度が減っても反応速度は遅くならない。
・濃度が減っても反応が遅くならないということは反応物がなくなるまで反応は進む。
全次数0が起こる例
普通の反応は濃度に依存します。
なぜなら反応物の濃度が大きいのならば、それらの分子などが衝突する可能性も高くなります。
それはすなわち反応を引き起こす可能性も高くなることも意味します。
ですから、反応次数が0で速度が濃度によらないというのは、特殊な場合になります。
しかし、このような例は少なくありません。
それはいわゆる律速段階となる別の反応(ボトルネック)が関わる時です。
ボトルネックがあるとき、反応の速度はその反応の速度に依存するため、対象となる反応の速度は一定になります。
アトキンス物理化学第10版(下)では、0次反応の例として、
・高温高圧でのタングステン上での水素化リンの接触分解
・酵素反応で酵素に比べて大量に基質があるとき
などが挙げられています。
まとめ
・反応次数とは、速度式における濃度の次数です。
・反応次数は、整数とは限りません。
・全次数は、それぞれの反応次数 a,b,c,d…を使って、a+b+c+d…と表せます。
・全次数が0の場合もあり、その場合の反応速度は一定になる。