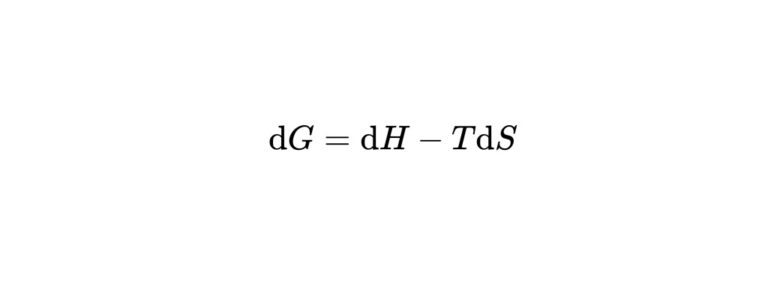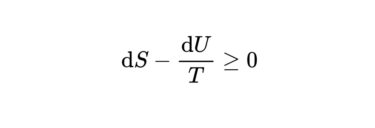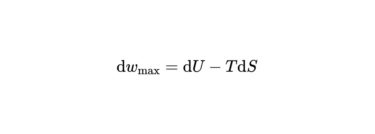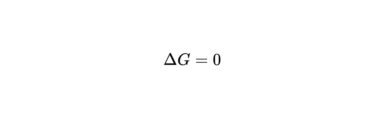ギブズエネルギーとヘルムホルツエネルギーがクラウジウスの不等式から導き出され自発性の基準になることをみてきました。
ヘルムホルツエネルギーとギブズエネルギーはよく似た式です。 その違いとそしてその意味について学習しましょう。 クラウジウスの不等式の利用 エントロピーは、反応がどのような方向に進むかの指標でした。 しかし、それを使うためには[…]
以前の記事で等温かつ等積のとき、ヘルムホルツエネルギーが反応の自発性の判断に使えるという話をしました。 [sitecard subtitle=関連記事 url=https://daigakuchem.com/gibbs/ target[…]
しかし、実際に用いることが多いのは、ギブズエネルギーです。
実験室で反応をさせるとき、基本的には定積ではなく定圧のもとで行われるからです。
そんなギブズエネルギーの利用をみてみましょう
ギブズエネルギーの利用
ある化学反応をみたとき、全体のギブズエネルギーが負の方向になるような方向に反応を進行します。
逆にギブズエネルギーの変化が正になるときには逆反応が進行することになります。
そうなると、ギブズエネルギーが0であるとき、化学平衡が成り立つということになります。
$$
\mathrm{d} G=\mathrm{d} H-T \mathrm{d} S
$$
ギブズエネルギーが負になるためにはエンタルピーの変化がなるべく負の方向に、エントロピーが正の方向になることが必要です。
エンタルピーの変化が正になる吸熱反応が自発的に進むためには、エントロピーの増大による寄与がそれを上回り総和としてギブズエネルギーが正になればいいことがわかります。
結論としてよく言われるのは、
反応はエネルギーが小さくなる(エンタルピーが小さくなる)か、エントロピーが増大する方向に進む
しかし、これらはどちらもギブズエネルギーの変化で表されます。
そして、根本をたどれば、系と外界のエントロピー変化の総和が正になる方向に反応が進むという極めてシンプルな一つの仮定から成り立っています。
膨張を伴わない最大仕事
ヘルムホルツエネルギーの変化は、一定温度で引き起こせる最大仕事であることを意味していました。
ギブズエネルギーにもそれに相当するものがあります。
結論から言うと、ギブズエネルギーの変化は”膨張を伴わない最大仕事”と等しくなります。
膨張を伴わない仕事とは、電気や張力による仕事のことです。これらから取り出せる最大の仕事が求められるので、
化学電池などでの計算にとても役立ちます。