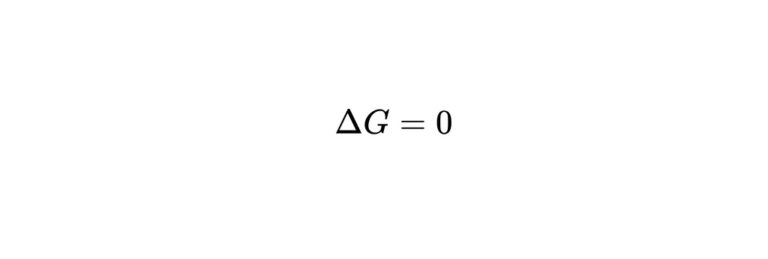自発性について示す指標としてギブズエネルギーの説明をしてきましたが、ここで一点補足をしておきます。
ギブズエネルギー変化が負のときは、反応が自発的に進み、正のときには反応は進まない(あるいは逆反応が進む)という話をしました。
では、ギブズエネルギー変化が0の時には反応は進むのでしょうか?それとも進まないのでしょうか?
そんな疑問を解決していきます。
ギブズエネルギー変化が0→平衡状態
$$
\Delta G=0
$$
結論からいうと、ギブズエネルギー変化が0ならば平衡状態になります。
しかし、注意しなければいけないのは、平衡状態が反応をしないという意味ではないということです。
もっと言うと、平衡状態でも反応は進行しています。
そう言える理由に関しては次の述べますが、今回の疑問「ギブズエネルギー変化が0ならば反応は進行しないのか」についての答えは、
「ギブズエネルギー変化が0でも反応は進行しているが見かけ上進んでいないように見える」
となります。
平衡状態の反応
アトキンス物理化学第10版(東京化学同人)には、
すべての化学平衡の特徴である動的平衡の状態では、順反応と逆反応が同じ速度で起こっており、いずれかの方向に変化する正味の傾向はない。(出典:アトキンス物理化学(上)第10版)→amazonでチェック
とあります。つまり、平衡状態とは、反応が停止した状態ではなく、正の方向への反応と逆反応が同じ程度に反応しているので見かけ上、反応していないように見えるということです。
平衡状態は、平衡であっても反応しているということから動的平衡(dynamic_equilibrium)とも呼ばれます。
結論:ギブズエネルギー変化0でも反応は進行している。
上の化学平衡についての説明を踏まえると、「ギブズエネルギー変化が0ならば反応は進行しないのか?」という疑問は自然に解消されたのではないでしょうか?
ギブズエネルギーはあくまでも自発的に反応しやすいかどうかの指標なので、ギブズエネルギー変化が負であるからといって、逆反応が進行しないわけでも、ギブズエネルギー変化が正だからといって正反応が進まないわけでもありません。
ギブズエネルギー変化の値の絶対値が極めて大きく明らかに反応が偏っている時以外は、絶えず逆の反応も行われていると考えてよいでしょう。
もっと知りたい方へ
ギブズエネルギーの変化についてもっと知りたいという方におすすめの参考書を紹介します。
アトキンス物理化学
出版:東京化学同人
著:Peter Atkins
化学平衡の基礎
出版:学術図書出版社
著:姫野 貞之