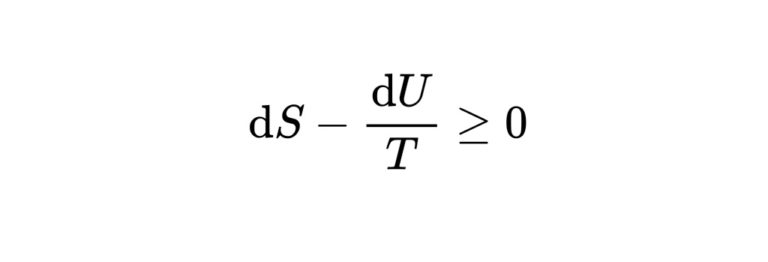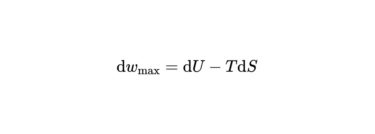ヘルムホルツエネルギーとギブズエネルギーはよく似た式です。
その違いとそしてその意味について学習しましょう。
クラウジウスの不等式の利用
エントロピーは、反応がどのような方向に進むかの指標でした。
しかし、それを使うためには、系のエントロピーの変化と外界のエントロピーの両方の総和を考えなければいけません。
つまり孤立系では系のみを考えれば、自発性を判断できましたが、外界が関わる場合には外界のエントロピー変化も考えなければいけなくなります。
そこで、この外界のエントロピー変化を系のエントロピーの変化のなかに組み込み、一つの式で表すことを考えます。
そんなときに登場するのがギブズエネルギーとヘルムホルツエネルギーです。
クラウジウスの不等式を定圧と定積の二つの条件で変形することでこれら二つのエネルギーが導かれます。
このことから導き出される熱力学第二法則と関連づけられる式が次のクラウジウスの不等式です。$$
\mathrm{d} S-\frac{\mathrm{d} q}{T} \geq 0
$$等式は可逆のときに成立します。
ヘルムホルツエネルギーの導入(定積下)
定積であるので、膨張での仕事はないと考え、\(\mathrm{d} q_{V}=\mathrm{d} U\)が成立します。
これを用いて、クラウジウスの不等式\(\mathrm{d} S-\frac{\mathrm{d} q}{T} \geq 0\)を書き換えると、次の式が成立します。
$$
\mathrm{d} S-\frac{\mathrm{d} U}{T} \geq 0
$$
これをすることによって自発性の判断の基準を系の状態関数のみで表現することができています。
さらに変形すると、
$$
\mathrm{d} U-T \mathrm{d} S \leq 0
$$
このとき左辺の式を利用して
$$
A=U-TS
$$
とすることでヘルムホルツエネルギーAを導入することができます。
ギブズエネルギーの導入(定圧下)
定圧下で、膨張以外の仕事がない場合、\(\mathrm{d} q_{p}=\mathrm{d} H\)がなりたつ。
これをクラウジウスの不等式に代入すると、次のように表されます。
$$
\mathrm{d} S-\frac{\mathrm{d} H}{T} \geq 0
$$
これをさらに変形すると、
$$
\mathrm{d} H-T \mathrm{d} S \leq 0
$$
となります。このとき、ヘルムホルツエネルギー同様に左辺の形を利用すると、
$$
G=H-T S
$$
というギブズエネルギーを導入することができます。
自発性の判断
これまで確認したことをまとめると次のように表されます。
$$
A=U-TS
$$
微小変化
$$
\mathrm{d} A=\mathrm{d} U-T \mathrm{d} S
$$ギブズエネルギー
$$
G=H-T S
$$
微小変化
$$
\mathrm{d} G=\mathrm{d} H-T \mathrm{d} S
$$
\mathrm{d} A_{T}, \mathrm{v} \leq 0
$$
\mathrm{d} G_{T, p} \leq 0
$$
補足:自発性を表す根拠
ギブズエネルギー、ヘルムホルツエネルギーが自発性を表す仕組みをもっと詳しくみてみましょう。
ここはやや難しいため、理解できないと感じたら読み飛ばしておきましょう。
そもそも最初に説明した通り、外界を考えなくていい孤立系ではエントロピーが増大するほうに自発的に反応が進みます。
そこで閉鎖系へと拡張され外界との熱の移動を考える時、外界のエントロピー変化との総和を考えなくてはいけません。
つまり、
$$
\Delta S+\Delta S_{sur}>0
$$
となればいいと言うことです。右側のSは系のエントロピー変化、左側は外界のエントロピー変化です。
このとき、外界のエントロピーを考えないようにするために、系の状態関数である\(\Delta H\)と\(\Delta U\)を使います。
そうやって求められたのが、
$$
\mathrm{d} S-\frac{\mathrm{d} H}{T} \geq 0
$$
$$
\mathrm{d} S-\frac{\mathrm{d} U}{T} \geq 0
$$
の2式です。
これらを変形すると、先ほどのエントロピーの総和による自発の式と同値であることがわかります。
よってギブズエネルギーとヘルムホルツエネルギーが反応の自発性に関わることが示されました。