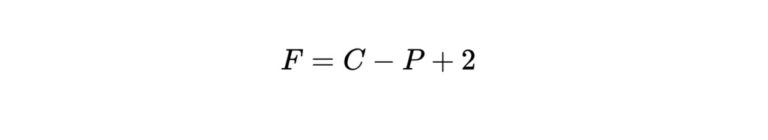熱力学で目覚ましい発見をいくつもしたギブズが導出した相律という言葉を聞いたことがある人も多いと思います。
ここでは、化学熱力学で出てくる相律とは何か見ていきましょう。
相律とはなにか?
結論から言うと相律とは、平衡状態にある相を保ち同時に値を変更できるパラメーターの量を表すものです。
相律は次のように表されます。
$$F=C-P+2$$
C:系の中の独立的な化学種(イオンや分子)の種類の数
P:平衡にある相の数
F:可変度(独立に変えられるパラメータの数)
相律の利用
例えば見ている系の独立的な化学種が1種類の場合、C=1であるので相律の式から、
$$F=-P+3$$
となります。
1相の場合
そしてこの単成分の系が1つの相であるとき、P=1であるので、上の式からF=2です。
これはつまり、自由に変えられるパラメータが2つ。例えば、圧力と温度を独立に決めることができるということを意味します。
2相での平衡
この単成分の系が2相にまたがって平衡状態になっている場合、P=2ですので、上の式からF=1です。
つまり独立に決められるパラメータが1つなので、ある状態量を決めた場合、他の量は自動的に決まることになります。
例えば、圧力を変えると、温度や体積も同時にある値に勝手に決まることになります。
3相での平衡
この単成分の系が3相にまたがって平衡状態になっている場合、P=3ですので、上の式からF=0です。
つまり独立に決められるパラメータが一つもないので、すべての状態量は全て決まっていることになります。
このとき、相図で言うと三重点の状態にあることになります。
まとめ
相律とは相が平衡にあるときに独立に変えられるパラメータを示すものです。
これを知っておくと相図などの理解に役立ちます。