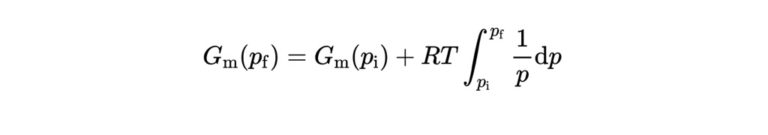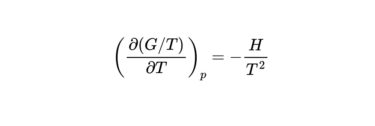ギブズ-ヘルムホルツの式はギブズエネルギーの温度変化を表すものでした。
今回は、圧力変化によるギブズエネルギーの変化をみていきましょう。
化学熱力学で学ぶ式のうちのひとつに、ギブズ-ヘルムホルツの式があります。 結論から言うと、ギブズ-ヘルムホルツの式は次のように表されます。 $$ \left(\frac{\partial(G / T)}{\partial T}[…]
圧力変化によるギブズエネルギー変化
それではある圧力におけるギブズエネルギーを他の圧力での値からもとめてみましょう。
ギブズエネルギーに関する熱力学の基本式は、\(\mathrm{d} G=V \mathrm{d} p-S \mathrm{d} T\)であり、
温度が一定のとき、最後の項は無視できるので\(\mathrm{d} G=V \mathrm{d} p\)となります。
これを1molあたりの量で積分すると、
$$
G_{\mathrm{m}}\left(p_{\mathrm{f}}\right)=G_{\mathrm{m}}\left(p_{\mathrm{i}}\right)+\int_{p_{\mathrm{i}}}^{p_{\mathrm{f}}} V_{\mathrm{m}} \mathrm{d} p
$$
となります。
この式は、系にある物質の状態によって使われ方が違います。
固体と液体の場合
固体と液体は、圧力による体積変化が小さいため体積は圧力によらないとみることができます。
そのため、積分の中から体積を出すことができ、次のように書き換えられます。
$$
G_{\mathrm{m}}\left(p_{\mathrm{f}}\right)=G_{\mathrm{m}}\left(p_{\mathrm{i}}\right)+V_{\mathrm{m}} \int_{p_{i}}^{p_{i}} \mathrm{d} p
$$
積分を計算するとモルギブズエネルギーの変化は次のようになります。
$$
G_{\mathrm{m}}\left(p_{\mathrm{f}}\right)=G_{\mathrm{m}}\left(p_{\mathrm{i}}\right)+\left(p_{\mathrm{f}}-p_{\mathrm{i}}\right) V_{\mathrm{m}}
$$
気体の場合
気体は圧力によって体積が大きく左右されるので、積分の外に体積を出すことができません。
そこで、気体の状態方程式Vm=RT/pを代入します。
$$
G_{\mathrm{m}}\left(p_{\mathrm{f}}\right)=G_{\mathrm{m}}\left(p_{\mathrm{i}}\right)+R T \int_{p_{\mathrm{i}}}^{p_{\mathrm{f}}} \frac{1}{p} \mathrm{d} p
$$
これで積分が容易にすることができるようになり、結果としてギブズエネルギーの圧力変化として次のように表せます。
$$
G_{\mathrm{m}}\left(p_{\mathrm{f}}\right)=G_{\mathrm{m}}\left(p_{\mathrm{i}}\right)+R T \ln \frac{p_{\mathrm{f}}}{p_{\mathrm{i}}}
$$
この式はしばしば、標準圧力と比較して用いられるため、\(p_{i}=p°=1bar\)とした式
$$
G_{\mathrm{m}}(p)=G_{\mathrm{m}}°+R T \ln \frac{p}{p°}
$$
を今後よく使います。
まとめ
圧力によるギブズエネルギーの変化は次のように表せます
・固体液体の場合、\(G_{\mathrm{m}}\left(p_{\mathrm{f}}\right)=G_{\mathrm{m}}\left(p_{\mathrm{i}}\right)+\left(p_{\mathrm{f}}-p_{\mathrm{i}}\right) V_{\mathrm{m}}\)
・気体の場合、\(G_{\mathrm{m}}\left(p_{\mathrm{f}}\right)=G_{\mathrm{m}}\left(p_{\mathrm{i}}\right)+R T \ln \frac{p_{\mathrm{f}}}{p_{\mathrm{i}}}\)
・とくに標準圧力(1bar)を基準にする時、\(G_{\mathrm{m}}(p)=G_{\mathrm{m}}°+R T \ln \frac{p}{p°}\)