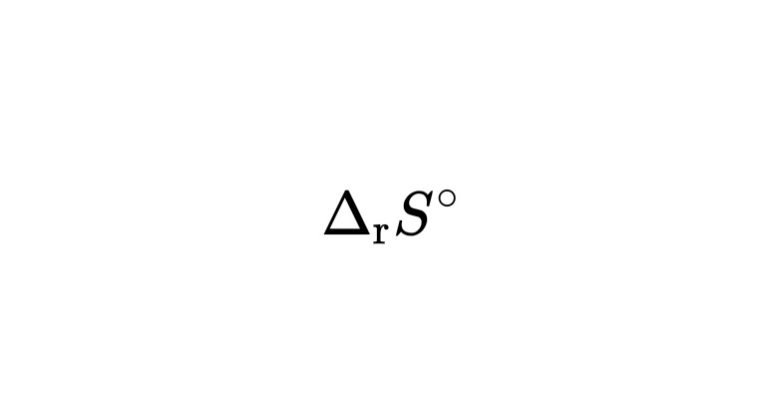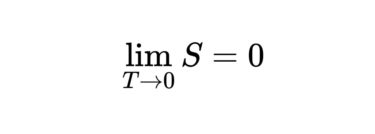化学熱力学の分野でよく聞く標準反応エントロピーとはなんだろうか?
物理や化学の内容では、よく標準〇〇という言葉が使われることがあるが、この”標準”が何を指しているか曖昧なことが多いです。
標準反応エントロピーもっと、一般に標準エントロピーの意味をみていきましょう。
標準エントロピー
標準エントロピーは、標準第三法則エントロピーとも言われます。
第三法則とは、ネルンストの熱定理から発展した熱力学第三法則のことで、詳しい内容は以下の記事にまとめています。
この第三法則では、T=0に近づくにつれて、S=0つまり次の式が成り立つことを表しています。
$$
\lim _{T \rightarrow 0} S=0
$$
そして、このT=0でS=0であることを基準として表現されたエントロピーを第三法則エントロピーといいます。
ですから、標準(第三法則)エントロピーとは、標準状態で温度TのときのエントロピーをT=0,S=0を基準に決められたもので、このように表されます。
$$
S°(T)
$$
右上の丸は標準状態を意味します。
標準状態を定義するにあたって主に、一定の温度と圧力が使われることが多いですが、今回の場合、温度Tでのエントロピーを求めることから、温度は関係なく圧力Tが定められています。このときの指標としては、SSP(standard-state pressure)という1barの圧力が使われています。つまりこの場合の標準状態とは、1barの圧力のもと、純粋で、理想的な状態であることを指します。
標準反応エントロピー
それでは、標準反応エントロピーについてみていきましょう。
標準反応エントロピーは、標準状態での生成物と反応物のエントロピーの差のことです。式では以下のように表されます。
$$
\Delta_{\mathrm{r}} S°=\sum_{\text {生成物 }} \nu S_{\mathrm{m}}°-\sum_{\text {反応物 }} \nu S_{\mathrm{m}}°
$$
エントロピーの前についてある\(\nu\)は、量論係数といわれ、いわゆる化学反応式の係数にあたります。
溶液中イオンのエントロピー
以上が標準反応エントロピーの説明ですが、
ついでに、溶液中のイオンのエントロピーについても説明します。
溶液中のイオンの標準エントロピーは、水中の\(H^{+}\)を基準に相対的に表現されます。
ここでのイオンの標準エントロピーが小さければ小さいほど、水に局所的に秩序だった構造を与えます。
つまり、おそらく小さく高い電荷をもつものほど水を配向させ秩序立てるためにエントロピーも小さくなると考えられています。
まとめ
・T=0でS=0であることを基準として表現されたエントロピーを第三法則エントロピーといいます。
・標準(第三法則)エントロピーとは、標準状態で温度TのときのエントロピーをT=0,S=0を基準に決められたもので、次のように表されます。
$$
S°(T)
$$
・標準反応エントロピーは、標準状態での生成物と反応物のエントロピーの差のことです。
$$
\Delta_{\mathrm{r}} S°=\sum_{\text {生成物 }} \nu S_{\mathrm{m}}°-\sum_{\text {反応物 }} \nu S_{\mathrm{m}}°
$$