素反応と遂次反応
今回は物理化学、化学熱力学の分野の中から素反応と遂次反応というテーマを扱っていきます。
素反応
多くの反応は1段階ではなく、多くのステップで構成されています。
そのステップのなかで、簡単なステップに分解したそれぞれの反応を素反応といいます。
素反応では、反応速度もそれぞれの反応分子数に依存した反応速度を示します。
というのも
という反応は、1分子素反応と呼ばれるように1つの分子が異性化するか、崩壊するような反応です。
この場合、その分子の濃度に比例する反応速度になることは明らかです。
そのため、のように1次の反応速度式が書けます。
あるいは、
という反応では、AとBが衝突して反応します。
そのため、それぞれの濃度に依存した反応速度になります。
そのため、
という二次の速度式を書くことができます。
ここであらためて注意する必要があるのは、
このように言い切れるのはあくまでも素反応であるからです。
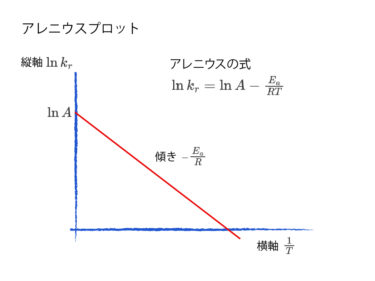
素反応でない場合には、化学反応式の化学量数がそのまま反応次数になるわけではなく、反応次数は実験によってのみわかります。
遂次反応
という反応をみていきます。
この反応においてはBという中間体を経由して反応が進んでいきます。
中間体は不安定で反応段階では現れますが、長いスケールでみたときに反応はのように見えてBは存在しないと考えます。また、逆反応は考えません。
このようなときの反応速度を考えます。
(1)より
(2)と(1)より
(5)に(4)を用いることで、
この微分方程式をという条件を用いて解くと
となります。
さらに、であるので、
と最終生成物の濃度が初期濃度によって表現することができました。
まとめ