化学系の大学院試験直前の対策として、大学院の試験に出題されうる大事な用語やキーワードの説明や導出をしています。
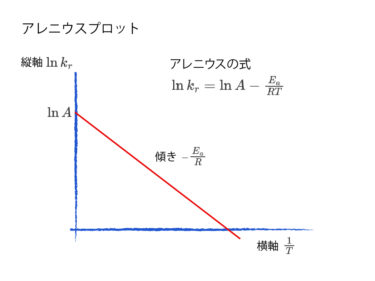
今回は物理化学、化学熱力学の分野の中から平衡での反応速度というテーマを扱っていきます。
スポンサーリンク
平衡での反応速度
平衡に近い反応では逆反応を考えなければいけません。
平衡での正味の濃度変化を考える方法を考えていきます。
正味の変化速度
という反応をみていきます。
このとき、順反応と逆反応がともに濃度の1乗に比例するとかんがえます。
したがって、順反応では反応物は減少して逆反応では増加するという単純な正味の変化量はつぎのようになります。
このとき、つまり、Bの最初の濃度を0であると仮定すると、反応物と生成物の濃度の和は、常に最初のAの濃度のみに依存することになるので、次の式が成り立ちます。
この式を用いれば、[B]を消去することができるようになります。
つまり、
この微分方程式を解くと次のように答えがでます。
この式はt→∞にするにつれて
となることを示唆します。
また[B]の最終濃度についても
となります。
ここから平衡定数は、
となることがわかり、これは今までの知識とは矛盾しません。
なぜなら、平衡ではお互いの生成速度は等しくなるため、
であるからです。
もしも上記の微分方程式の解き方をわすれてしまったときにはこれらのことから無理やり導出することもできるのでしっかり理解しておきましょう。