指標表は何のためにある?
無機化学をはじめ、量子化学や有機化学でもでてくる指標表。
突如として現れ、対称性であわあわしている大学生をあざ笑うかのように困らせてきます。
記号が多く、何を表しているのか最初はさっぱりわかりません。しかも、何に使うのかもよくわからないまま習うこともあり、化学を勉強するものにとっての大きな壁ではないでしょうか。
さて、この指標表が何のためにあるかですが、それは分子軌道の対称性の相性をわかりやすくするためです。
もっというと、何も考えずにわかるようにするために記号が用いられているのです。
おそらく、指標表を学ぶ前に分子の対称性や点群を学習します。
点群も分子がもつ対称要素でグループ分けをするものでした。
点群の記号があるおかげで、わたしたちは、分子がどのような対称性があるのかを一目で理解することができます(記号の意味をおぼえていたら...)
それと同じように、今度はそれぞれの点群がもつ軌道の対称性を数字で表しています。
軌道の対称性について
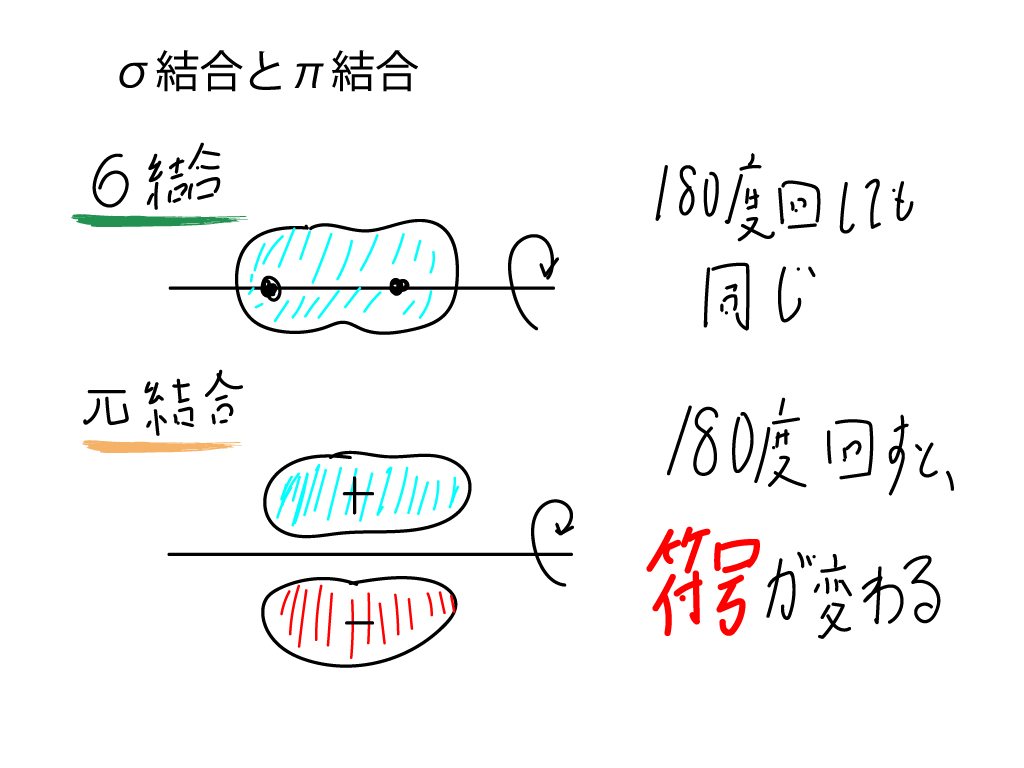
軌道の対称性といってちんぷんかんぷんな人は、σ結合(軌道)とπ結合(軌道)を思い出してください。
σ軌道は、核を結ぶ直線状に成立しますね。それに対して、π軌道は、核を結ぶ直線に対して+と-という風に符合の違う電子雲が存在しました。
このとき、σ結合は、180度回転させても何も変わらないのに対して、π結合は180度回すと符合が変わります。
このように、軌道には符合があるため(量子化学参照)、このように回転などの対称操作したときの符合の変化を考えなければいけないのです。
σとπという二つの単純な記号で表せるのは直線分子のときだけで、これが非直線になると対称性は複雑になり、違う記号をつかわなければいけません。
それが、A1B2やeやgといったものなのです。
指標表の読み方
下にあるのはC2vの指標表です。
C2vというと、水(H2O)が代表的ですね。今回はこのC2vの指標表をみながら指標表の読み方をざっくり説明します。
今見たらところどころ数字がゆがんでますが許してください(笑)※深夜2時半に作りました。
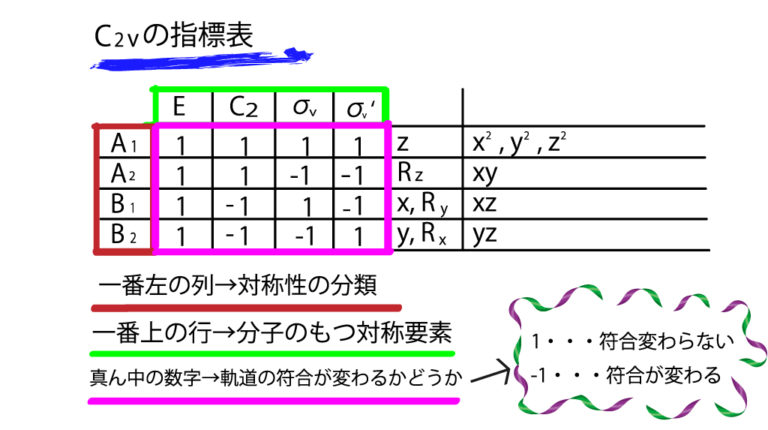
C2vの指標表
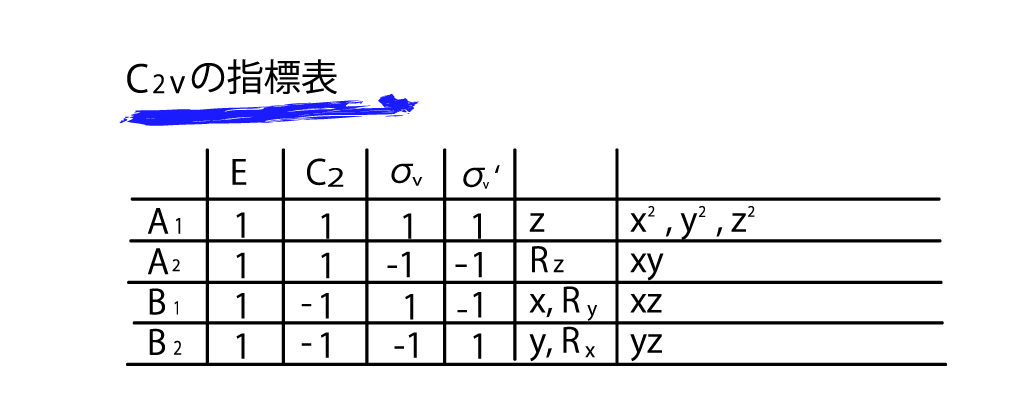
この指標表の読み方を詳しく見ていきましょう。まずはこの表を部分ごとに分けて整理していきましょう。
まず、一番左の列です。これらA1,A2,B1,B2といった記号は先ほど軌道の対称性で説明したように、σやπといった対称性を表す分類だとおもってください。
つまり、C2vの対称性を持つ分子は、これらA1,A2,B1,B2という4つのパターンの対称性を持つ分子軌道が存在しうるということです。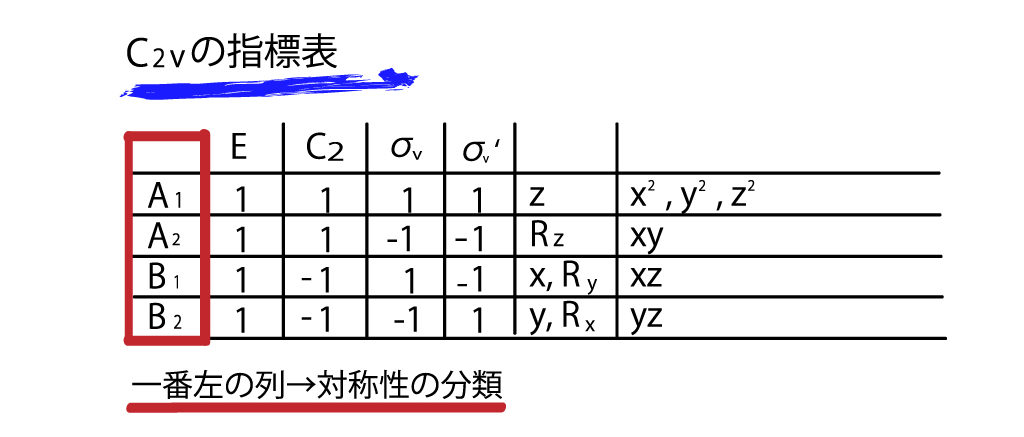
そして次に、一番上の行をみてみます。これは、対称要素の記号ですね。C2vのもつ対称要素が羅列されています。当然、別の点群の指標表は、それぞれのもつ対称要素が上の列にきます。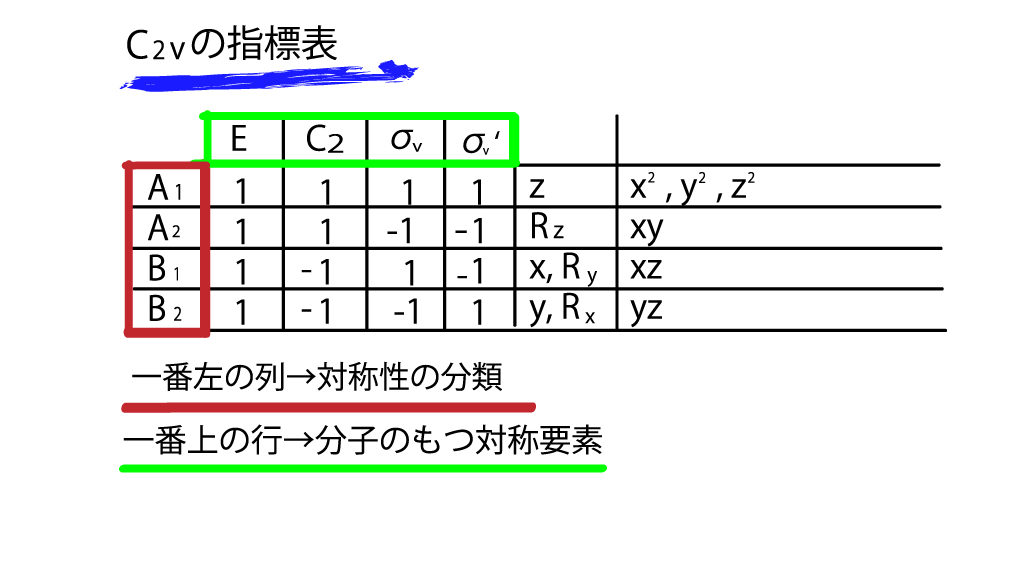
次に真ん中のブロックです。1や-1といった数字が並べられています。これが指標表をややこしくする原因なのですが、基本的に
1・・・ 符合が変わらない
-1・・・符合が逆になる
だと思ってください。
しかし、ときおり、2や0など、1や-1以外の数字が登場します。
これは、例えば二重に縮退している軌道を考えるときに二つとも軌道の符合が変わらなければ、1と1で合計で2となり、もしも、ある軌道は符合が変わり、またある軌道は変わらないというときには1と-1で0となるように合計を表しているからです。
つまり、指標表では縮退している(エネルギー準位が同じ)軌道は簡約化して表現していることに注意が必要です。
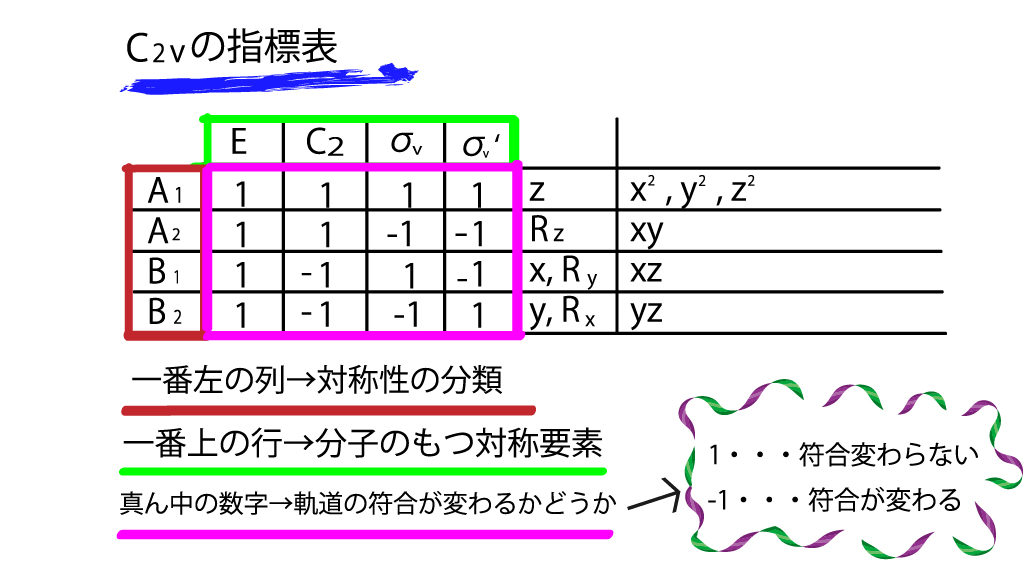
つまり、読み方としては、A1の軌道は、対称要素Eのもつ対称操作では軌道の符合が変わらない。という風になります。
Eは恒等操作なので符合が変わらないのは当たり前ですよね。
では次にB2の行、C2の列をみてください。-1となっています。
C2ということは、二回回転なので、これはC2軸に対して180度回転させることを表しており、それで-1になるということは、その操作で軌道の符合が変わるような位置関係にあるということです。
つまり、この部分からわかることは次のようになります。
・もし、ある軌道がB2の対称性をもつということがわかっていれば・・・
→ C2軸に対して180度の操作で軌道の符合が変わることがわかる。
・また、逆にC2軸に対して180度回転の操作で軌道の符合が変わることが分かっているならば・・・
→その軌道が、B2という分類、あるいは、B1という分類に当てはまることがわかる
※B1もC2の列が-1であるから。もし、ほかの対称操作での符合の変化がわかれば、B2であることがわかるようになる。
このように、今、何を考えているかで読み取り方は変わっていますが、それぞれが何を表すかを知っていればある程度わかるようにはなります。
分子軌道の組み立て
ここまでくれば指標表はある程度読めるようになっているはずです。
指標表を読めるようになれば、今度は分子軌道が組み立てられるようになります。
というのも、分子軌道というのは、原子軌道の重ね合わせとしてみることができるわけですが、そのときに注意するのは
同じ対称性の原子軌道が重なり合って分子軌道を作るということです。
つまり先ほど見たσ対称(180度回転させても同じ)をもつ原子軌道は、同じくσ対称を持つ原子軌道と分子軌道をつくり、π対称(180度回転させたら符合が変わる)をもつ分子とは分子軌道をつくりません。
そしてもう一つ大事なこととして、原子軌道の線形結合されてできる軌道もまた対称性をもち、対称性が適合するものと分子軌道をつくるということです。
ここから話がごちゃごちゃしますが、簡単に言うと、対称性が合う原子軌道が線形結合された軌道をつくり、その軌道がさらに対称性のある軌道と分子軌道をつくるということです。
つまり、さっきみたA1とかB2とか、そういった軌道の対称性が合うもの同士が次々に組み合わさっていくイメージです。
教科書では水やアンモニアなど比較的簡単な分子でそれらの説明がなされていると思います。
ここに書いた指標表の読み方をみながらもう一度その説明を読んでみてください。
すると、なんとなく言っていることがわかると思います。
それでは、今回はここまでとします
最後まで読んでいただきありがとうございました。
大学院試験対策におすすめの参考書
本サイトでは基本的な問題の解説をしていますが、著作権などの都合上、問題設定や数値はオリジナルの問題になっています。
実際に大学院試験に出題された問題を見たいという方はこれらの参考書を使って対策をすることをおすすめします。
おすすめの無機化学参考書
無機化学演習 大学院入試問題を中心に
無機化学演習 大学院入試問題を中心に
こちらの参考書は、原子構造、分子構造、固体構造といった物質の構造や酸化還元や酸塩基などのベーシックな反応に関する問題を取り扱っています。
例題には出題もととなる大学院の名前も書いてあるため、自分の受験する大学院の難易度と比較しながら問題を解くことができます。
例題に対して解説の分量が多く、とても丁寧な書き方がされているので、いきなりこの問題集を使っても問題なさそうです。